塑库网消息---2020年10月7日,法国生物化学家埃玛纽埃尔·沙尔庞捷(Emmanuelle Charpentier)和美国结构生物学家珍妮弗·杜德纳(Jennifer A. Doudna)这对女搭档斩获了诺贝尔化学奖。这是在《科学》杂志发表具有里程碑意义的论文仅仅八年后!

为什么是她们获奖?

女神级的人物!
埃马纽埃尔·卡彭蒂耶,1968年12月11日生于法国的奥尔日河畔于维西,法国微生物学家,遗传学家和生物化学家。EmmanuelleCharpentier被誉为“基因编辑之母”,已经获得10项久负盛名的科学奖项,目前担任德国马普学会感染生物学研究所所长,过去20年在5个不同的国家、9所不同的大学工作过。
詹妮弗·杜德纳,美国生物学家,加州大学伯克利分校的化学和分子生物学与细胞生物学教授。JenniferA. Doudna还曾在2016年获得世界杰出女科学家成就奖。
2011年,杜德纳开始与沙尔庞捷合作发展 CRISPR 技术。一年后,两位女生物学家在《科学》杂志发表论文并首次指出,CRISPR-Cas9 系统在体外实验中能“定点”对 DNA 进行切割,显著提升了基因编辑的效率,为该领域的发展奠定了基础。两位科学家被《时代》周刊评为 2015 年全球最具影响力100人,并收获了包括生命科学突破奖在内的多项生命科学大奖。
CRISPR-Cas9 基因编辑系统是本世纪最为重要的生物发现之一。2015 年,《科学》将它评为年度突破;助力这项技术诞生的科学家们也先后获得了有“科学界奥斯卡”之称的“突破奖”(Breakthrough Prize),在分子生物学界影响深远的“格鲁伯遗传学奖”(Gruber Genetics Prize),以及表彰重大生物医学突破的“沃伦·阿尔珀特奖”(Warren Alpert Prize)。
在2014年12月的《环球科学》中,《编辑基因:更快、更准、更简单》一文就对这项技术的作用机制、发展历程及前景展开详细介绍。虽然争议尚存,但毫无疑问,这项在2015年被《科学》杂志评为“年度科学突破”的新兴技术,正在开创一个全新的时代。
诺奖官网称,这项技术对生命科学产生了革命性的影响,可以帮助研究者开发新的癌症疗法,并使治愈遗传疾病的梦想成为现实。
“基因剪刀”的来历
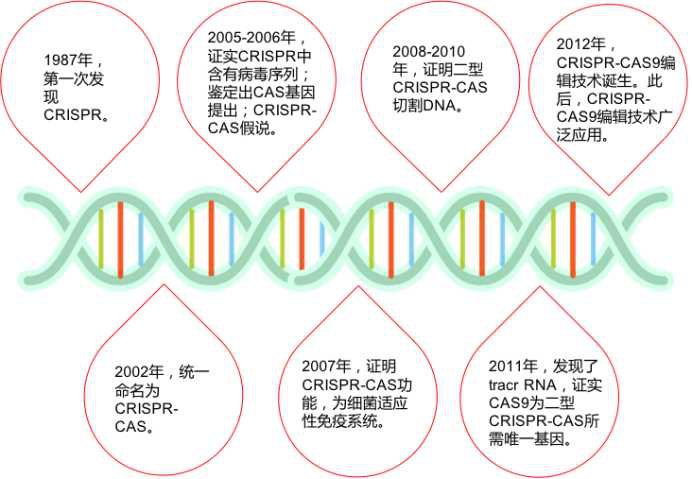


切开DNA的魔剪
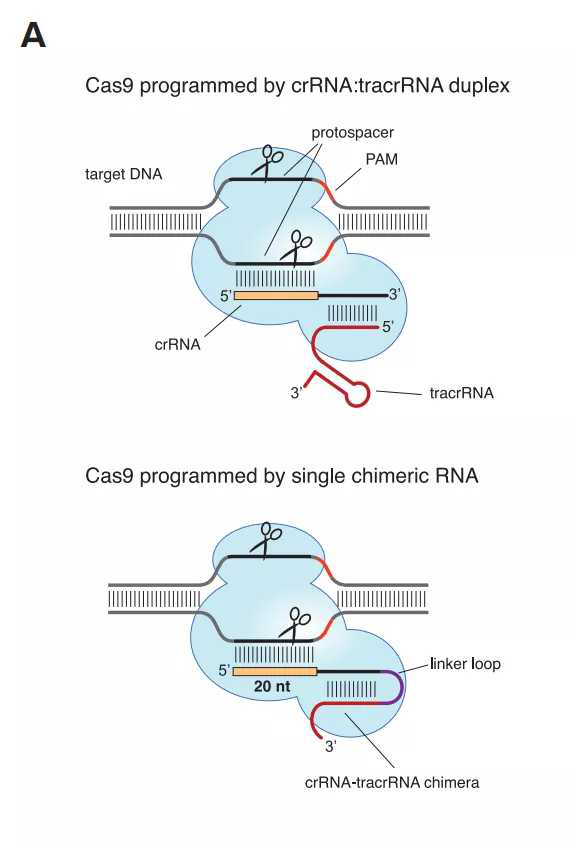

基因剪刀技术的意义是什么?
为什么8年就拿下诺奖?
我们看到CRISPR基因编辑技术发现史上英雄无数,而杜德纳和夏彭蒂耶发明的CRISPR/Cas9被称为是“基因技术中最锐利的工具之一”,一度震撼了科学界。
Cas9酶就像一对能够切割DNA链的分子剪刀,一旦酶在特定位点切割DNA,就可以进行插入和编辑,从而改变DNA序列。

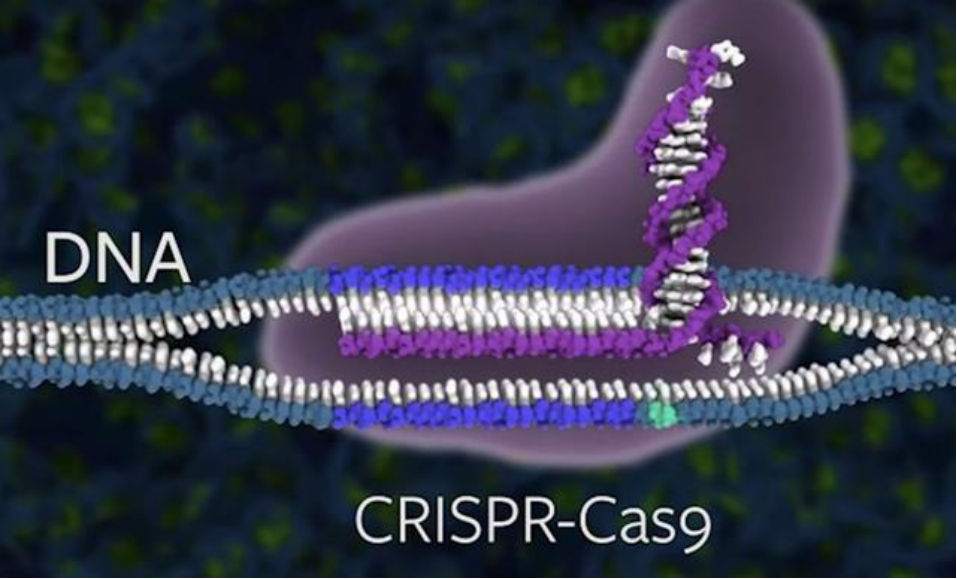
这把“剪刀”能否商业化呢?
CRISPR-Cas9 很快成为了投资的热点。2013 年,杜德娜联手丘奇、麻省理工学院的张锋和其他研究人员,共同成立了爱迪塔斯医药公司(Editas Medicine),他们获得了 4 300 万美元的风险投资,用以开发一类新的、基于 CRISPR 的药物。2014 年 4 月,获得 2 500 万美元投资的 CRISPR 医疗公司(CRISPR Therapeutics)在瑞士巴塞尔和英国伦敦成立,他们的目标也是开发基于 CRISPR 的疾病疗法。爱迪塔斯医药公司和 CRISPR 医疗公司都需要多年时间,才能开发出相应的疗法,然而,实验室的供货商们已经在向世界各地的客户销售可以立即用于动物注射的 CRISPR 材料,并开始为客户定制经 CRISPR 改造的小鼠、大鼠和兔子。
“基因剪刀”的前景与风险
CRISPR 已经勇猛地踏上了商业化的征途,研究人员和商人都在为这种技术设想新的商业用途,其中的某些想法甚至有些狂妄。运用这种技术,医生或许可以在怀孕早期的妇女体内,改造与唐氏综合征有关的异常染色体;育种人员可以重新向抗性杂草的基因组中引入对除草剂敏感的基因;我们还可以复活已经灭绝的物种。这当然会让有些人感到害怕。比如,最近就有一些警告性的头条报道,将这种技术形容为“扮演上帝的好方法”,或者“瓶中妖”。
2014 年 7 月 17 日,哈佛大学的团队发表一篇讨论如何用 CRISPR 消灭疟蚊的论文时,他们也指出了基因改造在技术与监管上的窘境。该团队的生物伦理学家让蒂宁· 伦斯霍夫(Jeantine Lunshof)说:“CRISPR 的发展如此迅猛,很多人还没听说过这种技术,但是我们确实正在使用它。这是一种新现象。”
2014 年 8 月,坦普尔大学(Temple University)的病毒学家卡迈勒·哈利利(Kamel Khalili)领导的研究人员报道,他们已经用 CRISPR 在数个人类细胞系中对 HIV 病毒进行了剪切。
上世纪 80 年代起,哈利利一直奋战在对抗 HIV/AIDS 的前线。对他来说,CRISPR 是场不折不扣的革命。尽管艾滋病治疗已经取得了巨大的进步,但今天的药物仅仅能控制病毒,仍然不能根除疾病。不过,运用 CRISPR,哈利利团队已经彻底从细胞中清除了 HIV 的完整 DNA 拷贝,将受感染的细胞转化了成无病毒细胞。并且,除了“清洗”已经感染病毒的细胞,CRISPR 还可以将一段病毒序列整合进未受感染的细胞中,对其进行免疫——正如杜德娜和她的团队在原始的细菌中观察到的那样。你可以将这种手段称作“基因疫苗”。哈利利说:“这是终极的治疗方法,如果你在两年前问我,‘你能精准地切割人类细胞中的 HIV 吗?’我可能会说这非常困难。但现在,我们做到了。”

这二位头戴诺贝尔奖“王冠”的女性,是改变世界的柔软力量。世界需要科学,科学需要女性的参与。
当年,诺贝尔在遗嘱中写道:这个奖项要表彰给“最有着价值的人”。

 塑库专家服务
塑库专家服务
 新品选材
新品选材
 3000+ 合作案例
3000+ 合作案例
 缺陷解决
缺陷解决
 专业团队1V1跟进
专业团队1V1跟进
 热门文章
热门文章